Figura 1. Lesión producida por
Sclerotinia sclerotiorum en la base del tallo.
|

Figura 2. Vuelco por marchitez y podredumbre basal por Sclerotinia.
|
Síntomas y signos
Podredumbre de la raíz, podredumbre basal del tallo y marchitez por
Sclerotinia: El primer síntoma sobre el suelo de esta enfermedad es el marchitamiento repentino de plantas de girasol antes o durante la floración, estas plantas con síntomas suelen distribuirse en manchones dentro del lote. El agente causal,
S. sclerotiorum, es un hongo que invade a traves de las raíces de la planta hospedante y puede igualmente, afectar las plantas adyacentes a través del contacto entre las raíces. Con el tiempo, en la base del tallo se desarrollan lesiones húmedas color marrón claro (Fig.1), que pueden obstruir los haces vasculares del tallo. Si la enfermedad continúa desarrollándose en la planta, el tallo se torna blanquecino y degradado y la médula se descompone. Las plantas infectadas pueden volcarse fácilmente en campos con fuertes vientos (Fig. 2). El tiempo entre el marchitamiento de las plantas infectadas y su muerte oscila entre cuatro a siete días. Los esclerocios negros (2 a 10 mm de diámetro) pueden encontrarse dentro y ocasionalmente por fuera del tallo. La presencia de esclerocioos relativamente grandes pueden ayudar a distinguir esta enfermedad de otras enfermedades de tallo como la marchitez por
Verticillium y la podredumbre carbonosa por
Macrophomina phaseolina (Markell et al. 2015).

Figura 3. Esclerotos producidos por Sclerotinia sclerotiorum dentro del tallo del girasol.
|  Figura 4. Tallos con una apariencia deshilachada provocados por la infección de
Sclerotinia. Figura 4. Tallos con una apariencia deshilachada provocados por la infección de
Sclerotinia. |
Podredumbre del tallo por
Sclerotinia: Los síntomas pueden aparecer en cualquier momento después de la implantación del cultivo, pero la enfermedad ocurre mayormente a la mitad o al final del ciclo del cultivo. Inicialmente, lesiones pequeñas y de apariencia húmedas se desarrollan en las plantas cerca de la línea del suelo. Al progresar la enfermedad, síntomas secundarios pueden aparecer en la planta, lo cual incluye marchitamiento, blanqueamiento y destrucción del tallo. La médula por debajo de las lesiones del tallo suele contener crecimiento micelial y abundantes esclerocios negros (Fig. 3). Además, los esclerocios son vistos por fuera del tallo. Al progresar la enfermedad, el tallo puede quebrarse y deshilacharse visibilizándose solo los haces vasculares (Fig. 4). Los síntomas de la podredumbre de tallo por
Sclerotinia pueden confundirse con los del cancro de tallo por
Phomopsis. Sin embargo, mientras las lesiones por
Phomopsis son de color marrón claro a oscuro y carecen de esclerocios, en cambio, las lesiones provocadas por
Sclerotinia poseen esclerocios por dentro y por fuera del tallo que ayudan a diferenciarlas (Mathew et al. 2018).

Figura 5. Crecimiento de micelio blanco y esclerotos de
Sclerotinia sclerotiorum en el capítulo de girasol.
|
 Figura 6. Capítulo de girasol como una escoba de paja debido a la infección de
Sclerotinia. Figura 6. Capítulo de girasol como una escoba de paja debido a la infección de
Sclerotinia. |

Figura 7. Plantas de girasol severamente afectadas por Sclerotinia sclerotiorum en un campo
| 
Figura 8. Capítulo de girasol afectado por la podredumbre húmeda por Sclerotinia puede asemejarse a la podredumbre por
Rhizopus.
|
Podredumbre húmeda del capítulo y podredumbre del tallo por
Sclerotinia: Esta enfermedad puede ser común antes o después de la floración. Los síntomas de la podredumbre húmeda del capítulo por
Sclerotinia incluyen coloración oscura, lesiones húmedas en el envés del capítulo o la presencia de crecimiento de micelio blanco, que cubre los granos en desarrollo del capítulo (Fig. 5). Al continuar el desarrollo de la enfermedad,
S. sclerotiorum degrada el interior del capítulo y grandes esclerotos llenan el capítulo detrás de los granos y alrededor de estos. Al progresar la enfermedad, los capítulos infectados se desintegran y deshilachan, dejando grandes esclerocios (12 mm o mas grandes de diámetro). Al final, el capítulo termina pareciéndose a una escoba de paja (Fig. 6 y 7) y puede verse fácilmente desde lejos en el campo. Los síntomas de la podredumbre húmeda del capítulo pueden confundirse con la podredumbre del capítulo por
Rhizopus (Markell et al. 2015). Sin embargo, los capítulos de girasol afectados por
Rhizopus mostrarán una coloración grisácea y filamentos miceliales filiformes sin esclerocios (Fig. 8).
Biología del patógeno
Sclerotinia sclerotiorum sobrevive el invierno y otras condiciones ambientales desfavorables como esclerocio en el suelo o en el rastrojo, el cual le permite al hongo sobrevivir entre 3 y 5 años. El esclerocio puede tener una forma irregular, un rango de tamaño entre 2 a 5 mm de diámetro y hasta 2,5 cm de largo (Fig. 9; Heffer Link and Johnson 2007). Dependiendo de las condiciones ambientales, el esclerocio puede germinar carpogénicamente produciendo apotecios (y ascosporas) e infectando las partes aéreas de la planta hospedante o miceliogénicamente la cual infecta directamente las raíces de la planta (Bardin and Huang 2001; Bolton et al. 2006).

Figura 9. Esclerotos producidos por Sclerotinia sclerotiorum pueden variar en forma y tamaño. |
Para la germinación carpogénica, los esclerocios del hongo, sobre la superficie o dentro de los primeros dos centímetros del perfil del suelo, germinan para formar estructuras con formas de copa llamadas apotecios (Harveson 2011; Heffer Link & Johnson 2007). La formación de los apotecios es favorecida por temperaturas del aire entre 10 a 25 °C, alta humedad relativa (avorecida por canopeos densos (90%) y alta humedad del suelo (por prácticas de riego o lluvia) durante una a dos semanas (Bolton et al. 2006; Clarkson et al. 2004). Los apotecios están formados por un estípite (de 20 a 80 mm de longitud) y un receptáculo plano a cóncavo de color marrón claro (de 2 a 10 mm de diámetro) que sostiene el tejido portador de los ascos, el himenio (Bolton et al. 2006). Los ascos descargan con fuerza las ascosporas de forma elipsoidal (8 a 15 x 5 a 8 µm; Brooks 1953), y se desencadenan por una disminución repentina de la humedad relativa o por la perturbación del apotecio (Hartill & Underhill 1976). Las ascosporas son células hialinas, individuales y de pared celular delgada. Las ascosporas requieren temperaturas entre 20 a 25 °C, 48 a 72 horas de mojado foliar (por ejemplo, rocío, lluvia) y una fuente de nutrientes (por ejemplo, tejido muerto o senescente de plantas, o exudados de nectarios) para su germinación (Rothmann & McLaren 2018; Abawi & Grogan 1979). Las ascosporas sobreviven cerca de dos semanas después de su liberación de los apotecios.
En el caso de la germinación miceliogénica, los esclerocios de
S. sclerotiorum germinan para producir hifas que pueden directamente atacar la planta de girasol (Harvenson 2011). La germinación hifal de los esclerocios ocurrirá cuando el suelo este húmedo (entre el 30 y 100 % de la capacidad de retención del suelo) y bajo temperaturas entre 12 y 24 °C, favorecidas por precipitaciones o prácticas de riego (Rothmann & McLaren 2018; Heffer Link & Johnson 2007). La infección de las plantas seguido de la germinación hifal de los esclerocios, permite al hongo penetrar dentro de las raíces laterales, la raíz pivotante y el tallo causando la podredumbre de la raíz, la podredumbre basal del tallo y la marchitez por
Sclerotinia.
Ciclo de la enfermedad y epidemiología
Podredumbre de la raíz, podredumbre basal del tallo y marchitez por
Sclerotinia:
Sclerotinia sclerotiorum puede infectar el girasol a través de las raíces. Al comienzo del verano, particularmente en lotes con historial de moho blanco, el esclerocio puede germinar para producir el micelio color blanquecino hasta entrar en contacto con las raíces de las plantas de girasol. El hongo penetra las raíces laterales y luego avanza hacia la raíz pivotante, causando un decaimiento del sistema radicular. El contacto entre las raíces infectadas y raíces adyacentes de plantas sanas dentro del surco le permite a
S. sclerotiorum moverse de una planta a otra. El hongo crece a través de las raíces hacia el tallo y provoca la marchitez de la planta. Al progresar la enfermedad, los esclerocios se forman tanto en el tallo como en las raíces infectadas. Estos esclerocios retornan al suelo cuando las plantas se vuelcan o durante la cosecha y sirven de fuente de inóculo para el próximo cultivo susceptible. A mayor densidad de esclerocios, mayor será la duración de la infestación en el lote (Harveson 2011; Holley & Nelson 1986). Por ejemplo, la investigación de Holley y Nelson (1986) mostró que una densidad de inóculo menor que un esclerocio cada 800 cm3 de suelo seco puede resultar en una incidencia promedio de marchitez por
Sclerotinia del 40 % en girasol (Fig. 10).
Podredumbre del tallo por
Sclerotinia: Los apotecios producidos por
S. sclerotiorum pueden observarse en lotes de girasol hasta después del cierre del canopeo y las ascosporas producidas por los apotecios pueden originarse desde dentro del lote de girasol. Adicionalmente, las ascosporas pueden llegar por el viento desde los campos vecinos, donde los apotecios pueden estar presentes. Estas esporas se depositan en las hojas y pecíolos de las plantas de girasol. Cuando disponen de agua libre y nutrientes, las ascosporas germinan e infectan las hojas y los pecíolos y avanzan hacia el tallo, causando la podredumbre del tallo por
Sclerotinia (Harveson et al. 2016; Harveson 2011) (Fig. 10).
Podredumbre húmeda del capítulo y media del tallo por
Sclerotinia: Las ascosporas son los propágulos infectivos y requieren de mojado foliar y nutrientes para infectar. De manera similar a la podredumbre del tallo, las ascosporas usan las flores y el polen muertos como nutrientes de base para germinar. Las esporas penetran dentro del receptáculo y el capítulo decae completamente.
Sclerotinia sclerotiorum puede infectar el grano del girasol y existe como micelio en la cubierta de la semilla, pero las semillas infectadas son de menor importancia para el desarrollo de la enfermedad (Harveson et al. 2016; Harveson 2011) (Fig. 10).
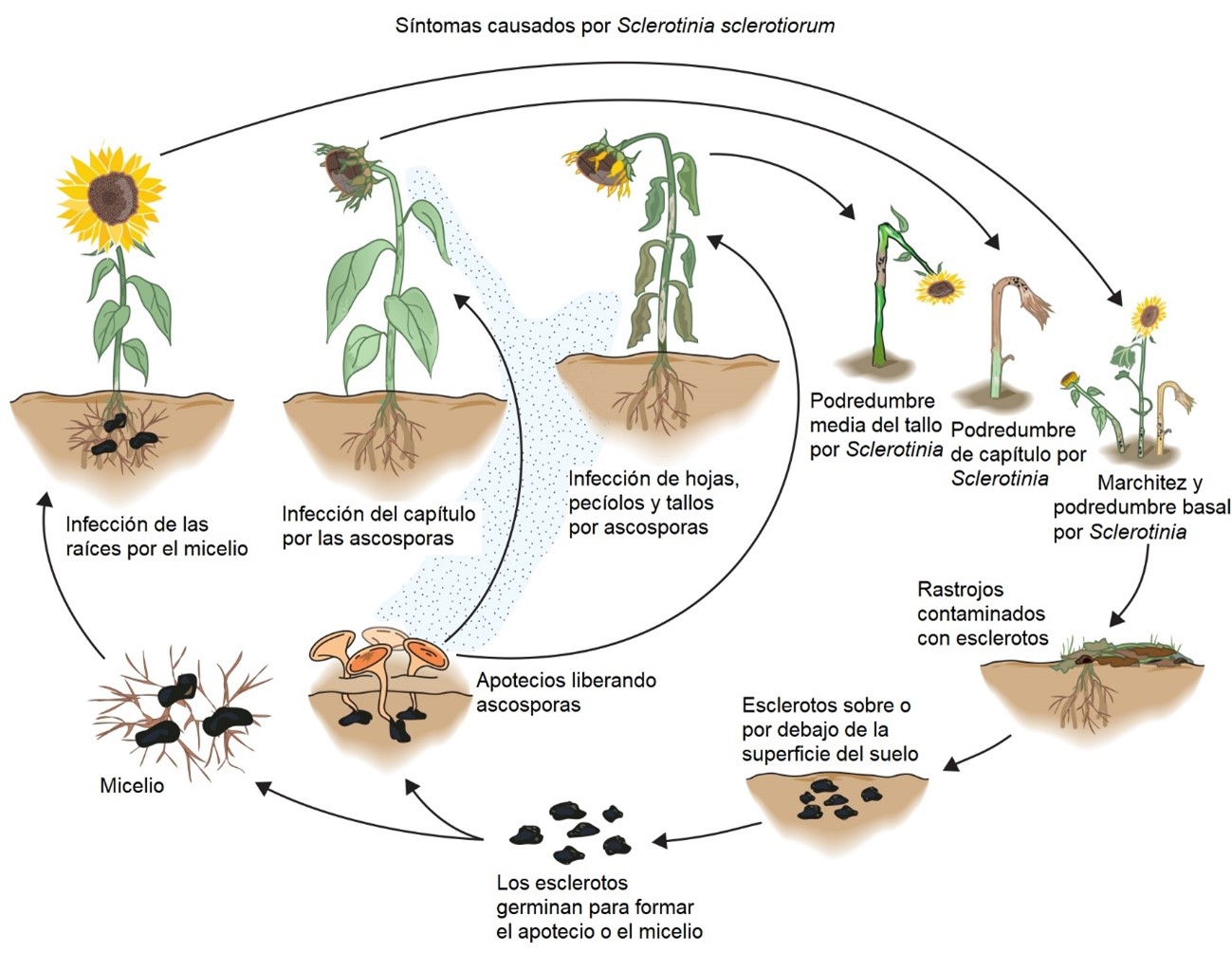
Figura 10. Síntomas causados por Sclerotinia sclerotiorum
Manejo de la enfermedad
Labranza: La implementación de labranza cero permite mejorar la germinación del esclerocio presente en la superficie del suelo. Sin embargo, combinando labranza cero con el uso de un cultivo no hospedante puede reducir el número de esclerocios que pueden infectar al cultivo susceptible en la campaña siguiente. En contraste, prácticas de labranza profunda puede ayudar a reducir el número de esclerocios presentes en la superficie del suelo; no obstante, el laboreo en una campaña posterior puede devolver los esclerocios enterrados a la superficie del suelo.
Rotación de cultivos: Para las tres enfermedades, un descanso en la rotación de tres a cinco años con cultivos no susceptibles como el trigo (Triticum L.), el sorgo (Sorghum bicolor (L.) Moench), y el maíz (Zea mays L.) puede reducir el número de esclerotos (Harveson 2011; Heffer Link & Johnson 2007). Con la ausencia de girasol (u otros cultivos susceptibles), el esclerocio puede germinar, pero sin la infección de un hospedante susceptible, nuevos esclerocios no pueden producirse y el número gradualmente se reduce. Sin embargo, una vez que
S. sclerotiorum se establece en un campo, la rotación de cultivos probablemente no sea efectiva debido a que los esclerocios pueden sobrevivir durante muchos años (Heffer Link & Johnson 2007).
Riego: El riego en lotes de girasol con alto nivel de agua en el perfil del suelo debería ser evitado, especialmente durante la floración, para prevenir la germinación carpogénica de los esclerocios (Weber 2017; Scherer 2007).
Densidad y espaciamiento entre surcos: Para el manejo de enfermedades causadas por
S. sclerotiorum en la mayoría de los cultivos incluyendo el girasol, se recomienda emplear la densidad mínima y un mayor distanciamiento entre surcos (Harveson et al. 2016; Zimmer and Hoes 1978).
Fertilización nitrogenada: Las aplicaciones de excesivas dosis de nitrógeno deberían evitarse ya que un exceso de nitrógeno puede promover densos canopeos que favorezcan un microclima propicio para el desarrollo de la enfermedad (Weber 2017; Harveson et al. 2016).
Manejo de malezas: Las malezas de hoja ancha que puedan estar presentes en los lotes de girasol pueden ser hospedantes de
S. sclerotiorum y entre estás pueden mencionarse: el “Cardo blanco" (Cirsium arvense (L.) Scop), el “Topinambur" (H. tuberosus L.), la “Quínoa" (Chenopodium album L.), la “Hierba mora" (Solanum americanum), el “Yuyo colorado" (Amaranthus spp. L.), la “Altamisa" (Ambrosia L.), la “Soja" (Glycine max), la “Malva indica" (Abutilon theophrasti Medik.), la “Vicia" (Vicia spp. L.) y “Girasoles silvestres" (H. annuus) (Heffer Link & Johnson 2007). Estas malezas pueden contribuir a la persistencia del inóculo y a la diseminación de las tres enfermedades, es por esto la importancia que tiene su manejo.
Control biológico: Existen micoparásitos, como
Coniothryium minitans Campbell, que pueden atacar directamente el esclerocio producido por
S. sclerotiorum. Aplicaciones de
C. minitans (Contans WG, Bayer CropScience, Research Triangle Park, NC) directamente sobre el suelo (en presiembra o poscosecha del cultivo) puede ayudar a la colonización del hongo y a la muerte del esclerocio (Bradley et al. 2007). Además, aplicaciones de
C. minitans hechas después de la cosecha, especialmente después de severas incidencias en girasol, puede contribuir a reducir el número y la supervivencia de los esclerocios (Weber 2017). Sin embargo, un control efectivo y económico de las enfermedades causadas por
S. sclerotiorum empleando
C. minitans en condiciones de campo todavía está por definirse (Harveson et al. 2016). Adicionalmente, la siembra inmediata de un cultivo susceptible como soja, colza o papa (Solanum tuberosum L.) en un campo con historial de Moho blanco no es aconsejable.
Control químico: La aplicación de funguicidas (por vía terrestre, aérea y/o a través del sistema de riego) es usada en Estados Unidos para el manejo de enfermedades. Actualmente, los productores de girasol están limitados a funguicidas cuyos principios activos estén dentro de los grupos FRAC 3 (Metconazol y tebuconazol), 7 (Boscalid, fluopiram y penthiopyrad) y/o 11 (Azoxistrobin y pyraclostrobin) para manejar estas enfermedades. Para la marchitez y la podredumbre basal del tallo por
Sclerotinia, el tratamiento de semillas con principios activos del grupo FRAC 11 (e.g. Pyraclostrobin) puede dar protección al cultivo durante la fase de siembra. Para podredumbre húmeda del capítulo y podredumbre del tallo medio, la aplicación de funguicidas con principios activos del grupo FRAC 7 (Por ej. Penthiopyrad) han sido indicados. Sin embargo, los resultados de la efectividad de los productos fungicidas pertenecientes a FRAC 7 no están disponibles o no han sido consistentes a lo largo de los años y/o ubicaciones (Seiler et al. 2017).
Resistencia genética: No se identificaron genes mayores en el girasol cultivado que puedan conferir una resistencia
S. sclerotiorum (Seiler et al. 2017). La genética de la resistencia a enfermedades causadas por
S. sclerotiorum es cuantitativa (i.e. multiples genes, lo cual complica los esfuerzos para mejorar y obtener cultivares resistentes. En la última década, hubo avances en la investigación para identificar fuentes de resistencia contra
S. sclerotiorum en girasol, particularmente en la podredumbre basal del tallo y la podredumbre húmeda del capítulo. Como ejemplos, cabe mencionar los trabajos de Block et al. (2009, 2010) en el que evaluaron 460 accesiones derivadas de 14 especies silvestres del género
Helianthus para la resistencia a la podredumbre basal de tallo por
Sclerotinia e identificaron a las especies
H. argophyllus Torr. & Gray,
H. debilis Heiser Jr.,
H. praecox Engelm. & Gray, y
H. petiolaris Engelm. & Gray como potenciales fuentes de resistencia. Por su parte, Talukder et al. (2014) evaluaron 260 introducciones (incluyendo líneas del programa del USDA-ARS) durante múltiples años y localidades de los estados de Minnesota, North Dakota y South Dakota de los Estados Unidos. Dos introducciones, PI531389 y OI531366, fueron determinadas como significativamente resistentes contra la podredumbre basal del tallo y la podredumbre húmeda del capítulo por
Sclerotinia al compararlas con el testigo susceptible. Sin embargo, la incidencia de la podredumbre húmeda del capítulo en estas introducciones correlacionó negativamente con la podredumbre de la base del tallo, sugiriendo que los genes que confieren resistencia a estas dos enfermedades pueden ser diferentes (Talukder et al. 2014). Seiler et al. (2017) identificaron nueve accesiones cultivadas aceiteras del Consejo de Investigación en Agricultura en Sudáfrica (Grain Crops Institute, Potchefstroom, South Africa) que presentaron una incidencia de la podredumbre basal del tallo menor o igual que un híbrido aceitero moderadamente resistente. Talukder et al (2019) transfirieron genes de resistencia a la podredumbre basal del tallo por
Sclerotinia de
H. praecox al girasol cultivado. Para el caso de la podredumbre del tallo por
Sclerotinia, desde la última investigación publicada por Miller & Gulya (1999) quienes desarrollaron líneas aceiteras mantenedoras y restauradoras con tolerancia a la enfermedad, no hubo progreso en la investigación para mejorar la resistencia a la enfermedad en el girasol cultivado.
Importancia
Las enfermedades causadas por
S. sclerotiorum en girasol, Podredumbre de la raíz, podredumbre de la base del tallo y marchitez por
Sclerotinia; Podredumbre del tallo por
Sclerotinia; y Podredumbre húmeda del capítulo y podredumbre media del tallo por
Sclerotinia, son responsables de altas pérdidas de rendimiento en los Estados Unidos y en otros países productores de girasol. Por ejemplo, pérdidas de rendimiento entre 10 y 20 % se observaron a causa de la Podredumbre húmeda del capítulo por
Sclerotinia (Gulya et al. 2019) y entre 5 a 70 % a causa de la Podredumbre basal del tallo y la marchitez por
Sclerotinia (Kolte 1985) en lotes de producción de girasol. Además del rendimiento, la podredumbre húmeda del capítulo por
Sclerotinia puede afectar la calidad del grano reduciendo el contenido de aceite en un 10 a 15 % y aumentando el contenido de ácidos grasos libres, lo que contribuye a la rancidez del aceite (Gulya et al. 2019). El manejo de enfermedades causadas por
S. sclerotiorum es limitado a la rotación con cultivos no hospedantes (como maíz y trigo), la elección de híbridos resistentes (si se encuentran disponibles), adecuadas prácticas de riego, el manejo de las malezas y el control biológico. Actualmente, existen tres grupos de funguicidas registrados para girasol contra estas enfermedades, pero los datos de eficacia no están disponibles o no son consistentes a través de años y/o localidades. Es por esto que para el manejo de las enfermedades causadas por
S. sclerotiorum, el mejoramiento genético y el desarrollo de híbridos con parcial resistencia al patógeno es la opción más efectiva de manejo. Sin embargo, la falta de fuentes efectivas de resistencia en el girasol cultivado y la naturaleza cuantitativa de la resistencia genética a la enfermedad han dificultado el progreso en el desarrollo de híbridos de girasol con resistencia a
S. sclerotiorum.
Bibliografía
Abawi, G. S., and Grogan, R. G. 1979. Epidemiology of diseases caused by Sclerotinia species. Phytopathology 169: 899-904.
Bardin, S.D., and Huang, H.C. 2001. Research on biology and control of Sclerotinia diseases in Canada. Can. J. Plant Pathol. 23: 88-98.
Bolton, M. D., Thomma, B., and Nelson, B. D. 2006.
Sclerotinia sclerotiorum (Lib.) de Bary: biology and molecular traits of a cosmopolitan pathogen. Mol. Plant Patho. 7: 1-16.
Block, C. C., Rashid, K. Y., and Gulya, T. J. 2016. Sclerotinia root rot, basal stalk rot, and wilt. Pages 57-59 in: Compendium of Sunflower Diseases and Pests. R. M. Harveson, S. G. Markell, C. C. Block, and T. G. Gulya, eds. American Phytopathological Society, St. Paul, MN.
Block, C. C., Marek, L. F., and Gulya, T. J. 2010. Evaluation of wild
Helianthus species for resistance to Sclerotinia stalk rot. Proceedings of the 8th Annual Sclerotinia Initiative Meeting, Bloomington, MN, USA, January 20-22, 2010.
Block, C. C., Marek, L. F., and Gulya, T. J. 2009. Evaluation of wild
Helianthus species for resistance to Sclerotinia stalk rot. Proceedings of the 7th Annual Sclerotinia Initiative Meeting, Bloomington, MN, USA, January 21-23, 2009.
Bradley, C., Markell, S., and Gulya, T. 2007. Irrigation management. Pages 54-77 in: Sunflower Production. D. R. Berglund, ed. North Dakota State University Extension, Fargo, ND, USA.
Brooks, F. T. 1953. Plant Diseases. Oxford Univ. Press, London, UK.
Clarkson, J. P., Phelps, K., Whipps, J. M., Young, C.S., Smith, J. A., and Watling, M. 2004. Forecasting
Sclerotinia disease on lettuce: toward developing a prediction model for carpogenic germination of sclerotia. Phytopathology, 94: 268-279.
Gulya, T., Harveson, R., Mathew, F., Block, C., Thompson, S., Kandel, H., Berglund, D., Sandbakken, J., Kleingartner, L., and Markell, S. 2019. Comprehensive disease survey of U.S. sunflower: disease trends, research priorities and unanticipated impacts. Plant Dis. 103: 601-618.
Hartill, W. F. T., and Underhill, A. P. 1976. 'Puffing' in
Sclerotinia sclerotiorum and
S. minor. New Zeal. J. Bot. 14: 355-358.
Harveson, R. M., Markell, S. G., Block, C. C., and Gulya, T. J. 2016. Compendium of Sunflower Diseases, 1st ed. American Phytopathological Society, St. Paul, MN, USA.
Harveson, R. M. 2011. Sclerotinia diseases of sunflower in Nebraska. NebGuide G2107, University of Nebraska Cooperative Extension, Lincoln, NE, USA. http://extensionpublications.unl.edu/assets/pdf/g2107.pdf
Heffer Link, V., and Johnson, K. B. 2007. White Mold. The Plant Health Instructor. DOI: 10.1094/PHI-I-2007-0809-01. Updated 2012.
Holley, R. C., and Nelson, B. D. 1986. Effect of plant population and inoculum density on incidence of Sclerotinia wilt of sunflower. Phytopathology 76: 71-74.
Huang, H. C., and Hoes, J. A. 1980. Importance of plant spacing and sclerotial position to development of Sclerotinia wilt of sunflower. Plant Dis. 64: 81-84.
Kolte, S. J. 1985. Diseases of annual edible oilseed crops volume III sunflower, safflower, and nigerseed diseases. CRC Press, Boca Raton, FL, USA.
Markell, S., Harveson, R., Block, C., and Gulya, T. 2015. Sunflower Disease Diagnostic Series. Publication PP1727. North Dakota State University Cooperative Extension Service, Fargo, ND, USA.
Masirevic, S., and Gulya, T. J. 1992.
Sclerotinia and
Phomopsis – two devastating sunflower pathogens. Field Crop Res. 30: 271-300.
Mathew, F., Harveson, R., Gulya, T., Thompson, S., Block, C., and Markell, S. 2018. Phomopsis stem canker of sunflower. Plant Health Instructor. DOI: 10.1094/PHI-I-2018-1103-01.
McLaren, D. L., Rimmer, S. R., and Huang, H. C. 1988. Survey of Sclerotinia wilt and head rot of sunflower in southern Alberta, 1987. Can. Plant Dis. Surv. 68: 126-127.
Miller J. F., and Gulya T. J. 1999. Registration of eight Sclerotinia-tolerant sunflower germplasm lines. Crop Sci. 39: 301-302.
Rashid, K. Y., Block, C. C., and Gulya, T. J. 2016. Sclerotinia head rot and midstalk rot. Pages 51-55 in: Compendium of Sunflower Diseases and Insects. R. M. Harveson, S. M. Markell, C. C. Block, and T. J. Gulya, eds. The American Phytopathological Society, St. Paul, Minnesota, USA. Pp: 51-55.
Rothmann, L.A., and McLaren, N. W. 2018.
Sclerotinia sclerotiorum disease prediction: A review and potential applications in South Africa. S. Afr. J. Sci. 2018; 114 , Art. #2017-0155, 9 pages. http://dx.doi.org/10.17159/sajs.2018/20170155.
Scherer, T. 2007. Irrigation management. Pages 16-17 in: Sunflower Production . D. R. Berglund, ed. North Dakota State University Extension, Fargo, ND, USA.
Sedun, F. S., and Brown, J. F. 1989. Comparison of three methods to assess resistance in sunflower to basal stem rot caused by
Sclerotinia sclerotiorum and
S. minor. Plant Dis. 73: 52-55.
Seiler, G., Misar, C. G., Gulya, T. J., Underwood, W. R., Flett, B. C., Gilley, M., and Markell, S. G. 2017. Identification of novel sources of resistance to Sclerotinia basal stalk rot in South African sunflower germplasm. Plant Health Prog. 18: 87-90.
Talukder, Z. I., Long, Y., Seiler, G. J., Underwood, W., and Qi, L. 2019. Introgression and monitoring of wild Helianthus praecox alien segments associated with Sclerotinia basal stalk rot resistance in sunflower using genotyping-by-sequencing. PLOS ONE 14: e0213065.
Talukder, Z. I., Hulke, B. S., Marek, L. F., and Gulya, T. J. 2014. Sources of resistance to sunflower diseases in a global collection of domesticated USDA Plant Introductions. Crop Sci. 54: 694-705.
Weber, J. M. 2017. Management of white mold in hybrid sunflower seed crops in the Columbina basin of Central Washington. MS Thesis, Washington State University, Pullman, WA, USA.
Zimmer, D. E., and Hoes, J. A. 1978. Diseases. In: Carter, J. F. (Ed.). Sunflower science and technology. Madison: American Society of Agronomy. p. 225-262.