ENFERMEDAD: Marchitez, abigarrado de la hoja, secado anticipado y quebrado del tallo por Verticillium del girasol
PATÓGENO: Verticillium dahliae Klebahn
HOSPEDANTE: Girasol (
Helianthus annuus L.)
Síntomas y signos
Los síntomas de la marchitez por
Verticillium se observan típicamente en las etapas de crecimiento cercanas o durante la floración y pueden estar presentes en una o en un grupo de plantas. Los síntomas iniciales se desarrollan en las hojas inferiores de las plantas y consisten en pequeñas áreas amarillas (cloróticas) entre las nervaduras de las hojas (Fig. 1). Estas áreas cloróticas se vuelven necróticas y de color marrón, y aún están rodeadas por tejido clorótico amarillento, lo que da a las hojas una apariencia abigarrada (Fig. 2). Los síntomas, que aparecen primero en las hojas inferiores, se mueven gradualmente hacia arriba, desde la base hasta la parte superior de las plantas infectadas. Finalmente, las hojas de las plantas afectadas se marchitan y mueren (Gulya et al. 1997; Harveson y Markell 2016) (Fig. 3). A veces, el tejido vascular dentro del tallo desarrolla una coloración amarronada (Fig. 4). En plantas gravemente afectadas, la médula y el exterior del tallo pueden estar cubiertos por miles de microesclerocios de color gris a negro, lo que hace que parezcan negros (Fig. 5). Estos microesclerocios pueden sobrevivir en el suelo sin un hospedante durante al menos 14 años (Wilhelm 1955).
Los síntomas foliares causados por
V. dahliae pueden parecerse a los síntomas foliares del cancro del tallo por
Phomopsis, que es causado por especies de
Diaporthe (Mathew et al. 2018). En el caso del cancro del tallo por
Phomopsis, los tejidos entre las nervaduras de las hojas afectadas pueden volverse cloróticos y eventualmente necróticos, lo que lleva a la muerte prematura de las hojas. Se pueden observar lesiones de color marrón en el exterior de los tallos durante las etapas de floración, y con el tiempo, los tallos se vuelven débiles y huecos. Sin embargo, en el caso de la marchitez por
Verticillium, puede que no haya lesiones de color marrón en el exterior del tallo, y el interior de los tallos infectados puede observarse negro cuando se corta en sección transversal (Sadras et al. 2000) (Fig. 6).

Figura 1. Síntomas tempranos, hoja con lesiones internervales.
| 
Figura 2. Necrosis en las lesiones cloróticas, abigarrado.
| 
Figura 3. Hojas inferiores afectadas comienzan a morir.
|

Figura 4. Tejidos vasculares de color marrón rojizo en la parte inferior del tallo de una planta infectada (arriba) en comparación con una sana (abajo).
| 
Figura 5. Signos externos (arriba) e internos (abajo) en los tallos de plantas infectadas que muestran los microesclerocios de V. dahliae.
| 
Figura 6. Sección transversal de una planta de girasol infectada con marchitez por Verticillium.
|
Ciclo de la enfermedad e identificación del patógeno
Conidios y microesclerocios de V. dahliae pueden propagarse dentro y entre campos a través del agua de riego superficial, suelo infestado y/o semillas infestadas. Además, considerando que el micelio del hongo puede colonizar el pericarpio y la testa de las semillas (Sackston 1980), la transmisión de
V. dahliae puede facilitarse entre países a través de envíos de semillas (Zhang et al. 2018). El ciclo de la enfermedad se ilustra en un artículo de Berlanger y Powelson (2000).
El desarrollo de la enfermedad se ve favorecido por condiciones de suelo húmedo y temperaturas de 21 a 27 °C (70 a 81 °F). La infección en las plantas de girasol ocurre cuando los microesclerocios germinan y penetran las raíces (Sadras et al. 2000; Wilhelm 1955). La germinación de los microesclerocios es estimulada por los exudados de las raíces al suelo. El hongo penetra la raíz y coloniza la corteza produciendo hifas. Las hifas fúngicas continúan invadiendo los vasos del xilema, y se forman numerosos conidios en el ápice de las hifas. Estos conidios son transportados a través del xilema a las partes aéreas de la planta. Como resultado, el girasol infectado exhibe marchitez, reducción del área foliar, clorosis y necrosis foliar.
El hongo de crecimiento lento a menudo puede identificarse por los conidióforos (estructuras portadoras de conidios) que están dispuestos en verticilos alrededor de un eje central (Fig. 7). Este tipo de disposición de esporas se denomina "verticilada", lo que le da al hongo su nombre. En cultivos puros, el crecimiento fúngico es negro (Fig. 8) debido a las masas de pequeños microesclerocios que se forman en cadenas a partir de células hifales (Fig. 9) (Harveson 2009).
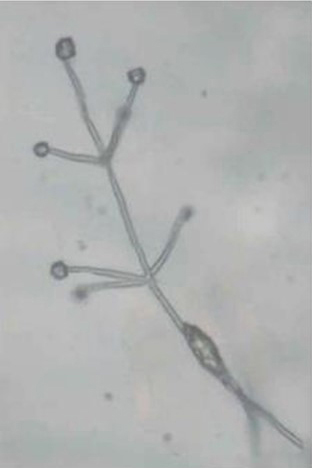
Figure 7. “Verticilos” conidióforos diagnósticos para
Verticillium.
| 
Figure 8. Crecimiento micelial negro característico de
V. dahliae.
| 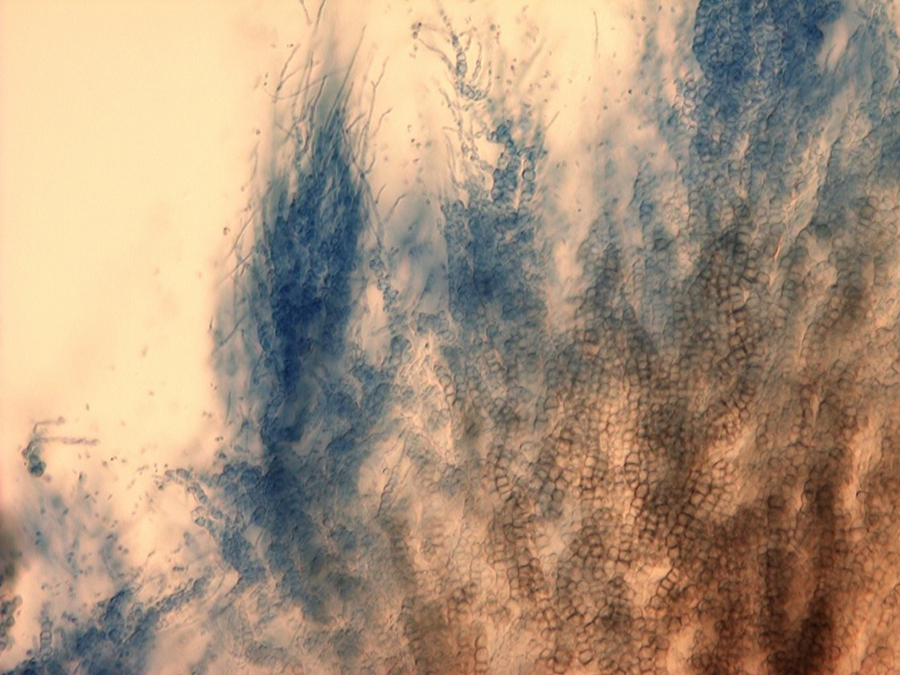 Figure 9. Microesclerocios de
V. dahliae formándose en cadenas en cultivo. Figure 9. Microesclerocios de
V. dahliae formándose en cadenas en cultivo.
|
Biología del patógeno
Hasta la fecha, no se identificó el estado sexual de
V. dahliae. Se considera un hongo asexual, y los conidios producidos por
V. dahliae en los vasos del xilema ayudan al hongo a adaptarse al nicho ecológico (Luo et al. 2016; Tian y Kong 2022).
Las cepas de
V. dahliae se clasificaron en grupos de compatibilidad vegetativa (VCG) basados en la capacidad de las hifas fúngicas de diferentes aislamientos individuales para fusionarse y formar heterocariones estables. Los VCG se determinan típicamente utilizando mutantes auxotróficos no utilizadores de nitrato (nit), que se preparan en un medio con nitrato como fuente de nitrógeno. Los aislamientos que forman heterocariones estables con mutantes
nit y producen crecimiento de tipo salvaje en el medio son vegetativamente compatibles y se colocan en el mismo VCG (Martín-Sanz et al. 2018). Además de las pruebas de complementación con mutantes
nit, la caracterización de VCG de aislamientos de
V. dahliae se realizó utilizando marcadores moleculares de diagnóstico (Carder et al. 1994; Collado-Romero et al. 2009; García-Carneros et al. 2014; Mercado-Blanco et al. 2001, 2002, 2003).
Hasta la fecha, los aislamientos de girasol se caracterizaron como VCG 1, VCG 2A, VCG 2B, VCG 4A, VCG 4B o VCG 6 (Alananbeh et al. 2011; El-Bebany et al. 2013; García-Carneros et al. 2014). En un experimento en invernadero realizado por Mathew (2014), se observó que los aislamientos de
V. dahliae pertenecientes a los VCG 4B y 2B causaron una severidad de la enfermedad significativamente mayor (70-100% de clorosis y necrosis) en la línea endocríada confitera susceptible 'HA 288' a los 49 días después de la inoculación en comparación con los aislamientos caracterizados como VCG 1, 2A, 4A y 6. Sin embargo, solo se evaluaron unos pocos aislamientos representativos en el estudio de Mathew (2014). No obstante, los aislamientos de
V. dahliae pertenecientes al mismo VCG pueden ser poblaciones genéticamente distintas que tienen un rango de hospedantes, patogenicidad y rasgos fisiológicos y ecológicos similares (Collado-Romero et al. 2009; Martín-Sanz et al. 2018).
En algunos cultivos, como el algodón (Gossypium sp.), los aislamientos de
V. dahliae pueden caracterizarse como patotipos defoliantes o no defoliantes, según la capacidad de los aislados para eliminar hojas sanas debido a la enfermedad (Bejarano-Alcázar et al. 1996). En girasol, utilizando marcadores de región amplificada caracterizada por secuencia (SCAR), Martín-Sanz et al. (2018) demostraron que los aislamientos de
V. dahliae obtenidos de Europa del Este (Bulgaria, Rumania y Turquía) eran patotipos defoliantes, mientras que los de Europa Occidental (Francia, Italia, España y Ucrania) y Argentina eran patotipos no defoliantes. Sin embargo, el estudio de Martín-Sanz et al. (2018) no evaluó las diferencias en patogenicidad entre los aislamientos de
V. dahliae identificados como patotipos defoliantes y no defoliantes.
Además de los patotipos, se describieron razas de
V. dahliae basadas en su capacidad para superar genes de resistencia individuales. En Estados Unidos, se identificó la primera raza (NA-1) cuando superó un único gen de resistencia principal (V1) en la línea endocríada HA89 (Gulya 2007a, b; Gulya et al. 1997). Después de la identificación de NA-1, se identificaron nuevas razas basadas en la caracterización fenotípica, que incluyó cuatro razas (VArg1, VArg2, VArg3 y VArg4) en Argentina identificadas utilizando las líneas endocríadas ADV29 y ADV53 (Clemente et al. 2017) y una raza ('Verticillium raza 2 Europa Occidental' [V2-WE]) que pudo superar el gen V1 en HA89 en España (García-Ruiz et al. 2014). En Europa, se identificaron tres razas, incluyendo 'Verticillium raza 2 Europa Oriental' (V2-EE), que causa enfermedad en INRA2603 y no en HA89; V2-WE, que es patogénica en HA89 y no en INRA2603; y V1, que es controlada tanto por HA89 como por INRA2603 (Martín-Sanz et al. 2018). Dado que INRA2603 y HA89 son líneas endocríadas públicas que son resistentes y/o susceptibles a
V. dahliae, Martín-Sanz et al. (2018) propusieron que estos genotipos pueden usarse como diferenciales para identificar razas patogénicas, además de HA458 (que es universalmente susceptible).
Manejo de la enfermedad

Figura 10. Maleza infectada por marchitez de
Verticillium.
|
La marchitez por
Verticillium es una enfermedad monocíclica y, por lo tanto, las estrategias de manejo tienen como objetivo reducir la cantidad de inóculo inicial y prevenir la enfermedad.
Rotación de cultivos: Rotar el girasol con maíz (Zea mays L.), trigo (Triticum sp.) u otros no hospedantes durante al menos tres años puede ayudar a reducir el inóculo del patógeno en los campos.
Labranza: Wheeler et al. (2020) examinaron el efecto de las prácticas de labranza (convencional y labranza reducida) sobre la marchitez por
Verticillium, la densidad de microesclerocios y el rendimiento del algodón. El uso de labranza reducida redujo la densidad de microesclerocios y mejoró el rendimiento. Sin embargo, tales estudios no se realizaron en campos de girasol para determinar la efectividad de las prácticas de labranza contra
V. dahliae.
Manejo de malezas: Las malezas en los campos de girasol, como
Abutilon theophrasti (hoja de terciopelo),
Amaranthus spp. (amaranto, ataco, yuyo colorado),
Ambrosia spp.,
Chenopodium album (quinoa, cenizo),
Cirsium arvense (cardo cundidor, cardo blanco),
Datura spp. (chamico),
Malva spp. (malva),
Polygonum persicari (duraznillo),
Senecio vulgaris (senecio, hierba cana),
Solanum nigrum (hierba mora),
Sonchus oleraceus (cerraja) y
Xanthium spp. (abrojos) (Fig. 10), son reservorios potenciales para especies de
Verticillium y deben ser controladas.
Control químico: Actualmente no hay fungicidas etiquetados para su uso en girasol contra especies de
Verticillium, y la investigación sobre control químico es limitada. Como ejemplo, un estudio de Addrah et al. (2019) mostró que remojar las semillas de girasol en fungicidas de flusilazol (Fungicide Resistance Action Committee 3, Inhibidores de la Desmetilación - Triazol) durante 12 h antes de la siembra puede ayudar a controlar la contaminación de
V. dahliae en las semillas.
Resistencia genética: La resistencia genética es la estrategia más efectiva para controlar la marchitez por
Verticillium en girasol, como se demostró durante las últimas cinco décadas. En la década de 1950, se identificaron fuentes de resistencia a
V. dahliae en Canadá (Putt 1958), y se determinó que la herencia de la resistencia (designada como V1) era cualitativa (Putt 1964). Los genes V1 se identificaron en líneas endocríadas del USDA (por ejemplo, HA89) en la década de 1970 (Fick y Zimmer 1974); estas líneas se utilizan para desarrollar híbridos resistentes en programas de mejoramiento público. Sin embargo, surgieron razas de
V. dahliae que no eran controladas por los genes V1 en HA89 (NA-Vd2) en los Estados Unidos (Gulya 2007a, b) y Argentina (Bertero de Romano y Vazquez 1984; Bruniard et al. 1984). Radi y Gulya (2007) identificaron nuevas fuentes de resistencia a NA-Vd2 en el germoplasma de girasol del USDA, como PI507901 e Interstate 4575 NS. Además, Gulya et al. (1997) identificaron las líneas endocríadas HA300 y HA371 como resistentes a NA-Vd2. Bruniard et al. (1984) desarrollaron las líneas V144, V99, V134 y V196 con resistencia a la raza argentina NA-Vd2 (Škorić 2016). El mecanismo de resistencia a NA-Vd2 puede ser recesivo o aditivo en algunas líneas endocríadas, y los mejoradores en Argentina consideraron mejorar la resistencia a
V. dahliae mediante la piramidación de loci de rasgos cuantitativos (QTLs) asociados con la resistencia a las razas VArg1 y VArg2 (Galella et al. 2012). En el estudio de Galella et al. (2012), se evaluaron líneas isogénicas (L1: resistencia a VArg1; L2: resistencia a VArg2) con los QTLs de resistencia para las razas VArg1 y VArg2; familias F3 y F4 (obtenidas cruzando L1 y L2); y una variedad susceptible (L51) por su resistencia a las dos razas en una cámara de crecimiento y bajo inóculo natural. Se observó que las familias F4 eran resistentes a VArg1 y VArg2, y no se observaron diferencias significativas en el contenido de aceite o el rendimiento entre las líneas F4 y los padres (Galella et al. 2012).
Algunos investigadores evaluaron especies silvestres de girasol para identificar fuentes de resistencia a
V. dahliae. Por ejemplo, Hoes et al. (1973) evaluaron 46 colecciones de
Helianthus silvestres (6 colecciones de
H. annuus de las provincias canadienses de Manitoba y Saskatchewan y 34 colecciones de
H. annuus y 6 colecciones de
H. petiolaris de 12 estados de EE. UU.). Se observó que
H. petiolaris era más resistente que
H. annuus. Además, las familias F1, F2 y F3 desarrolladas cruzando especies silvestres resistentes con una línea endocríada susceptible también eran resistentes, y sus distribuciones de frecuencia sugieren que la herencia de la resistencia es dominante o recesiva. Pustovoit y Krokhin (1978) evaluaron híbridos interespecíficos (cultivado
H. annuus ×
H. tuberosus) frente a
V. dahliae e identificaron que la herencia de la resistencia era recesiva o dominante complementaria (dos a tres genes), lo que puede dificultar el desarrollo de genotipos resistentes. Škorić (1984) determinó que
H. occidentalis,
H. hirsutus y
H. tuberosus eran parcialmente resistentes a
V. dahliae.
Importancia
La marchitez por
Verticillium es una enfermedad importante del girasol en Argentina, Bulgaria, Francia, Italia, Rumania, España, Turquía, Ucrania y los Estados Unidos (Debaeke et al. 2017; Galella et al. 2012; Gulya et al. 1997; Harveson y Markell 2016; Radi y Gulya 2007). Sin embargo, la prevalencia de la enfermedad en los Estados Unidos disminuyó entre 2014 y 2023 (F. Mathew, observación personal). Independientemente, se reportó la transmisión de
V. dahliae por semillas (Klosterman et al. 2009), lo que puede facilitar la propagación del hongo a áreas de producción de girasol actuales y nuevas en todo el mundo. Además,
V. dahliae tiene un amplio rango de hospedantes de más de 350 especies de plantas (Berlanger y Powelson 2000; Ryley et al. 2021) que pueden rotarse con girasoles o estar presentes en lotes comerciales de girasol como malezas. Las opciones de manejo actuales para los agricultores de girasol se limitan a la rotación de cultivos con no hospedantes, el manejo de malezas y el uso de híbridos comerciales con resistencia o tolerancia a
V. dahliae. Considerando la diversidad genética y patogénica de
V. dahliae, se propuso que las razas del hongo se determinen utilizando los tres diferenciales y líneas endocríadas públicas (HA458 [susceptible], HA89 e INRA2603) para desarrollar híbridos comerciales con resistencia efectiva al hongo (Martin-Sanz et al. 2018). En este momento, las opciones de manejo se limitan a la rotación de cultivos con no hospedantes, el manejo de malezas y el uso de híbridos resistentes (si están disponibles).
Referencias
Addrah, M. E., Zhang, Y., Zhang, J., Liu, L., Zhou, H., Chen, W., and Zhao, J. 2019. Fungicide treatments to control seed-borne fungi of sunflower seeds. Pathogens 9(1):29. doi: 10.3390/pathogens9010029
Alananbeh, K., Gudmestad, N., Gulya, T., and Markell, S. 2011. Determination of presumptive vegetative compatibility groups of Verticillium dahliae occurring on sunflower using molecular markers. Abstr. Phytopathology 101(6S):S4.
Bejarano-Alcázar, J., Blanco-López, M. A., Melero-Vara, J. M., and Jiménez-Díaz, R. M. 1996. Etiology, importance and distribution of Verticillium wilt of cotton in southern Spain. Plant Dis. 80:1233-1238. doi: 10.1094/PD-80-1233
Berlanger, I., and Powelson, M. L. 2000. Verticillium wilt. Plant Health Instructor. Online doi: 10.1094/PHI-I-2000-0801-01
Bertero de Romano, A., and Vazquez, A. N. 1984. Verticillium dahliae Kleb. Estimacion de perdidas de rendimiento pare distintas intensidades de ataque. In: Proc. 11th Int. Sunflower Conf. Mar del Plata, Argentina. Intl. Sunflower Conf. Toowoomba, Aust. 2:379-384.
Bruniard, J. M., Luduena, P. M., and Ivanovich, A. 1984. Selection of sunflower lines with resistance to Verticillium dahliae Kleb./IDIA 413/416. Estac. Exp. Reg. Agropec. INTA, Pergamino, Argentina. Pages 96-98.
Carder, J. H., Morton, A., Tabrett, A. M., and Barbara, D. J. 1994. Detection and differentiation by PCR of subspecific groups within two Verticillium species causing vascular wilts in herbaceous hosts. Pages 91-97 in: Modern Assays for Plant Pathogenic Fungi. A. Schots, F. M. Dewey, and R. Oliver, eds. CAB International, Oxford.
Clemente, G. E., Bazzalo, M. E., and Escande, A. R. 2017. New variants of Verticillium dahliae causing sunflower leaf mottle and wilt in Argentina. J. Plant Pathol. 99:445-451. doi: 10.4454/jpp.v99i2.3875
Collado-Romero, M., Berbegal, M., Jiménez-Díaz, R. M., Armengol, J., and Mercado-Blanco, J. 2009. A PCR-based 'molecular toolbox' for in planta differential detection of Verticillium dahliae vegetative compatibility groups infecting artichoke. Plant Pathol. 58:515-526.
Creus, C., Bazzalo, M. E., Grondona, M., Andrade, F., and León, A. J. 2007. Disease expression and ecophysiological yield components in sunflower isohybrids with and without Verticillium dahliae resistance. Crop Sci. 47:703-710.
Debaeke, P., Bedoussac, L., Bonnet, C., Bret-Mestries, E., Seassau, C., Gavaland, A., Raffaillac, R., Tribouillois, H., Véricel, G., and Justes, E. 2017. Sunflower crop: Environmental-friendly and agroecological. Oléagineux Corps Lipides 24(3). Online doi: D304 10.1051/ocl/2017020
El-Bebany, A. F., Alkher, H., Lorne, R. A., and Daayf, F. 2013. Vegetative compatibility of Verticillium dahliae isolates from potato and sunflower using nitrate non-utilizing (nit) mutants and PCR-based approaches. Can. J. Plant Pathol. 35:1-9.
Fick, G. N., and Zimmer, D. E. 1974. Monogenic resistance to Verticillium wilt in sunflowers. Crop Sci. 14:603-604. doi: 10.2135/cropsci1974.0011183X001400040036x
Galella, M. T., Bazzalo, M. E., Morata, M., Cimmino, C., Kaspar, M., Grondona, M., Reid, R., Zambelli, A., and León, A. 2012. Pyramiding QTLs for Verticillium dahliae resistance. Pages 219-224 in: Vol. 1. Proc. 18th Int. Sunflower Conf. Mar del Plata, Argentina. ISA, Paris.
García-Carneros, A. B., García-Ruiz, R., and Molinero-Ruiz, L. 2014. Genetic and molecular approach to Verticillium dahliae infecting sunflower. Helia 37:205-214. doi: 10.1515/helia-2014-0014
García-Ruiz, R., García-Carneros, A. B., and Molinero-Ruiz, L. 2014. A new race of Verticillium dahliae causing leaf mottle of sunflower in Europe. Plant Dis. 98:1435. doi: 10.1094/PDIS-04-14-0360-PDN
Gulya, T. 2007a. New strain of Verticillium dahliae in North America. Helia 30:115-120. doi: 10.2298/HEL0747115G
Gulya, T., Harveson, R., Mathew, F., Block, C., Thompson, S., Kandel, H., Berglund, D., Sandbakken, J., Kleingartner, L., and Markell, S. 2019. Comprehensive disease survey of U.S. sunflower: Disease trends, research priorities and unanticipated impacts. Plant Dis. 103:601-618.
Gulya, T., Rashid, K. Y., and Masirevic, S. M. 1997. Sunflower diseases. Pages 263-379 in: Sunflower Technology and Production. Agron. Monogr. 35. A. A. Schneiter, ed. American Society of Agronomy, Madison, WI.
Gulya, T. J. 2007b. Distribution of Plasmopara halstedii races from sunflower around the world. In: Advances in Downy Mildew Research. A. Lebeda and P. T. N. Spencer-Phillips, eds. Proc. 2nd Int. Downy Mildew Symp. 3:121-134.
Harveson, R. M. 2009. Verticillium wilt of sunflowers in Nebraska. NebGuide G1963. University of Nebraska, Lincoln, NE.https://extensionpublications.unl.edu/assets/pdf/g1963.pdf
Harveson, R. M., and Markell, S. G. 2016. Verticillium wilt. Pages 59-61 in: Compendium of Sunflower Diseases and Pests. R. M. Harveson, S. G. Markell, C. C. Block, and T. J. Gulya, eds. American Phytopathological Society, St. Paul, MN.https://doi.org/10.1094/9780890545096
Hoes, J. A., Putt, E. D., and Enns, H. 1973. Resistance to Verticillium wilt in collections of wild Helianthus in North America. Phytopathology 63:1517-1520.
Klosterman, S. J., Atallah, Z. K., Vallad, G. E., and Subbarao, K. V. 2009. Diversity, pathogenicity, and management of Verticillium species. Annu. Rev. Phytopathol. 47:39-62.
Luo, X., Mao, H., Wei, Y., Cai, J., Xie, C., Sui, A., Yang, X., and Dong, J. 2016. The fungal specific transcription factor Vdpf influences conidia production, melanized microsclerotia formation and pathogenicity in Verticillium dahliae. Mol. Plant Pathol. 17:1364-1381.
Martín-Sanz, A., Rueda, S., García-Carneros, A. B., González-Fernández, S., Miranda-Fuentes, P., Castuera-Santacruz, S., and Molinero-Ruiz, L. 2018. Genetics, host range, and molecular and pathogenic characterization of Verticillium dahliae from sunflower reveal two differentiated groups in Europe. Front. Plant Sci. 9:288. doi: 10.3389/fpls.2018.00288
Mathew, F., Harveson, R., Gulya, T., Thompson, S., Block, C., and Markell, S. 2018. Phomopsis stem canker of sunflower. Plant Health Instructor. Online doi: 10.1094/PHI-I-2018-1103-01
Mathew, F. M. 2014. Molecular characterization and pathogenicity of sunflower stem pathogens. Ph.D. dissertation, North Dakota State University Repository, Fargo, ND.https://hdl.handle.net/10365/27484
Mercado-Blanco, J., Rodríguez-Jurado, D., Parrilla-Araujo, S., and Jiménez-Díaz, R. M. 2003. Simultaneous detection of the defoliating and nondefoliating Verticillium dahliae pathotypes in infected olive plants by duplex, nested polymerase chain reaction. Plant Dis. 87:1487-1494.
Mercado-Blanco, J., Rodríguez-Jurado, D., Pérez-Artés, E., and Jiménez-Díaz, R. M. 2001. Detection of the nondefoliating pathotype of Verticillium dahliae in infected olive plants by nested PCR. Plant Pathol. 50:609-619.
Mercado-Blanco, J., Rodríguez-Jurado, D., Pérez-Artés, E., and Jiménez-Díaz, R. M. 2002. Detection of the defoliating pathotype of Verticillium dahliae in infected olive plants by nested-PCR. Eur. J. Plant Pathol. 108:1-13.
Pereyra, V., Quiroz, F., Agüero, M., and Escande, A. 1999. Relación del rendimiento de girasol con la intensidad de síntomas provocados por V. dahliae. In: Proceedings of the X Jornadas Fitosanitarias Argentinas 35.
Pustovoit, G. V., and Krokhin, E. J. 1978. The inheritance of resistance to major pathogens in interspecific sunflower hybrids. Pages 40-44 in: VNIIMK Review: Pests and Diseases of Oil Crops, Krasnodar. (In Russian).
Putt, E. D. 1958. Note on resistance of sunflowers to leaf mottle disease. Can. J. Plant Sci. 38:274-276. doi: 10.4141/cjps58-044
Putt, E. D. 1964. Breeding behavior of resistance to leaf mottle disease or Verticillium in sunflowers. Crop Sci. 4:177-179. doi: 10.2135/cropsci1964.0011183X000400020016x
Quiroz, F., Erreguerena, I., Clemente, G., and Escande, A. 2012. Impacto de la marchitez por Verticillium dahliae sobre el rendimiento de girasol. In: XIV Jornadas Fitosanitarias Argentinas. UNSL—FICES 165.
Radi, S., and Gulya, T. 2007. Sources of resistance to a new strain of Verticillium dahliae on sunflowers in North America–2006. Pages 10-11 in: Proceedings of the 29th Sunflower Research Workshop Bismarck, ND.
Ryley, M., Gulya, T., Mathew, F., Thompson, S., Block, C., Markell, S., and Harveson, R. 2021. Sunflower wilt diseases: Charcoal rot, Phialophora yellows, and Verticillium wilt. Plant Health Prog. 22:75-85.
Sackston, W. E. 1980. Some factors influencing infection of sunflower seed by Verticillium dahliae. Can. J. Plant Pathol. 2:209-212.
Sadras, V. O., Quiroz, F., Echarte, L., Escande, A., and Pereyra, V. R. 2000. Effect of Verticillium dahliae on photosynthesis, leaf expansion and senescence of field-grown sunflower. Ann. Bot. 86:1007-1015.
Škorić, D. 1984. Genetic resources in the Helianthus genus. Pages 37-73 in: Proc. Int. Symp. Sci. Biotechnol. Integral Sunflower Utilization, Bary, Italy.
Škorić, D. 2016. Sunflower breeding for resistance to abiotic and biotic stresses. In: Abiotic and Biotic Stress in Plants—Recent Advances and Future Perspectives. InTech. Online doi: 10.5772/62159
Tian, J., and Kong, Z. 2022. Live-cell imaging elaborating epidermal invasion and vascular proliferation/colonization strategy of Verticillium dahliae in host plants. Mol. Plant Pathol. 23:895-900.
Wang, D., Su, Z., Ning, D., Zhao, Y., Meng, H., Dong, B., Zhao, J., and Zhou, H. 2021. Different appearance period of Verticillium wilt symptoms affects sunflower growth and production. J. Plant Pathol. 103:513-517.https://doi.org/10.1007/s42161-021-00772-x
Wheeler, T. A., Bordovsky, J. P., Keeling, J. W., Keeling, W., and McCallister, D. 2020. The effects of tillage system and irrigation on Verticillium wilt and cotton yield. Crop Prot. 137:105305. Online doi: doi.org/10.1016/j.cropro.2020.105305
Wilhelm, S. 1955. Longevity of Verticillium wilt fungus in the laboratory and field. Phytopathology 45:180-181.
Zhang, Y., Zhang, J., Gao, J., Zhang, G., Yu, Y., Zhou, H., Chen, W., and Zhao, J. 2018. The colonization process of sunflower by a green fluorescent protein-tagged isolate of Verticillium dahliae and its seed transmission. Plant Dis. 102:1772-1778.