Lima, J. A. A.; Nascimento, A. K. Q.; Lima, R. C. A. and Purcifull, D. E. 2013. Amarelo Letal do Mamoeiro Vírus. Portuguese translation by J. Albérsio A. Lima, 2013. The Plant Health Instructor. 10.1094/PHI-I-2013-0724-02
Amarelo Letal do Mamoeiro
Papaya lethal yellowing virus
: Mamoeiro (Carica papaya L.)
Autores
J. Albérsio A. Lima, Universidade Federal do Ceará, Laboratory of Plant Virology
Aline K. Q. Nascimento, Universidade Federal do Ceará, Laboratory of Plant Virology
Roberto C.A. Lima, BioClone Produção de Mudas
D.E. Purcifull, 3106 NW First Avenue, Gainesville, FL 32607
Author e-mail: albersio@ufc.br
Traduzido por:
J. Albérsio A. Lima, Universidade Federal do Ceará, Fortaleza-CE, Brasil

Mamoeiro (Carica papaya) exibindo sintomas ocasionados por Papaya lethal yellow virus (PLYV)
O mamoeiro (Carica papaya) é uma importante fruteira tropical cuja produção vem crescendo no Nordeste do Brasil. O amarelo letal é uma doença ocasionada por Papaya Lethal Yellow Virus (PLYV) que ocorre somente no Nordeste brasileiro. Os sintomas ocasionados pelo PLYV são caracterizados por um amarelecimento progressivo das folhas do terço superior da copa, as quais murcham e finalmente morrem. Manchas circulares, inicialmente esverdeadas aparecem nos frutos e se tornam amareladas quando os frutos amadurecem. Os sintomas em plantas jovens inoculadas consistem em mosaico, amarelecimento e distorção foliar. As partículas do vírus são isométricas com 30 nm, com genoma composto por um único fragmento de single-stranded RNA (ssRNA) de aproximadamente 1,6 x 106 Da e uma capa proteica composta de uma única proteína de ca. 36 kDa. Embora não exista confirmação da existência de um vetor biológico, o vírus está se disseminando cada ano, possivelmente por mudas de plantas infetadas e ferramentas contaminadas. O vírus infeta somente Carica papaya, Jacaratia heterophyla, J. spinosa, Vasconcella cauliflora, V. quercifolia e V. monoica, todas espécies da família Caricaceae.O vírus é altamente estável e pode ser detectado em raízes e folhas secas mantidas em condições de laboratório durante 120 dias. Análise filogenética e da sequência de nucleotídeos da RNA-Dependent RNA Polymerase (RdRp) indicou que o PLYV é membro do gênero Sobemovirus, o que foi confirmado com a sequência completa do genoma.
Sintomatologia e Sinais
Sintomas
Os sintomas têm início com o aparecimento de um amarelecimento progressivo das folhas do terço superior da copa das plantas, as quais murcham e subsequentemente morrem seguidas da morte da planta inteira (Figura 1A, B). Manchas circulares de cor esverdeada aparecem nos frutos, as quais se tornam amareladas com amadurecimento dos frutos (Figura 1C). Plantas jovens inoculadas apresentam mosaico, distorção foliar (Figura 2A) e amarelecimento (Figura 2B). Alguns estudos demonstraram que o processo de maturação dos frutos de plantas infetadas é retardado e a polpa pode apresentar empedramento, depreciando o valor comercial e tornando os frutos inviáveis para consumo, sobretudo para exportação.
 Figuras 1
Figuras 1

Figuras 2
Estudos de casa de vegetação (estufa, pt) com plantas de mamoeiro duplamente infetadas demonstraram uma evidente e severa interação sinérgica entre PLYV e Papaya Ringspot Virus (PRSV). Os sintomas altamente severos apresentados pelas plantas duplamente infetadas por PLYV e PRSV consistiram de clorose, amarelecimento, redução de crescimento, necrose sistêmica e morte de 50% das plantas inoculadas. Plantas com infecção dupla de PLYV e PRSV, exibindo sintomas severos foram também, constadas em condições de campo. Este efeito sinérgico observado entre os dois vírus sugere que o uso de estirpes fracas de PRSV para proteção cruzada não deveria ser recomendado para o controle da mancha anelar do mamoeiro no Nordeste do Brasil.
Gama de Hospedeiros
Semelhante à maioria das espécies de vírus do gênero Sobemovirus, o PLYV possui estreita gama de hospedeiros, a qual está restrita a espécies botânicas da família Caricaceae. O vírus infeta todos os tipos e variedades comerciais de mamoeiro e também Jacaratia heterophyla, J. spinosa, Vasconcella cauliflora, V. quercifolia e V. monoica. As espécies J. heterophyla e V. monoica não são encontradas, em condições naturais, no Brasil, mas J. spinosa e V. quercifolia são cultivadas no sul e centro oeste do Brasil. Estudos de gama de hospedeiro indicaram que PLYV não infeta nenhuma das outras 82 espécies vegetais de 16 famílias botânicas diferentes que foram inoculadas com o vírus, inclusive as plantas indicadoras para vírus Chenopodium amaranticolor, C. murale, C. quinoa e Nicotina benthamiana. A ausência de sintomas e dos vírus nas plantas inoculadas foi confirmada por Indirect Enzyme-Linked Immunosorbent Assay (ELISA indireto).
Biologia do Patógeno
A Mancha Anelar do Mamoeiro é ocasionada pelo PLYV, o qual é membro do gênero Sobemovirus. As partículas do PLYV são isométricas com ca. 30 nm de diâmetro (Figura 3A). Grande quantidade de partículas do vírus pode ser observada através do microscópio eletrônico no citoplasma e vacúolos das células de folhas e de frutos de plantas infetadas (Figura 3B). O genoma do vírus é composto por um único fragmento de RNA de hélice simples (ssRNA) de ca. 1,6 x 106 Da, e sua capa proteica é formada por um único componente proteico de ca. 34,7 kDa. Elevada concentração de partículas do vírus foi purificada a partir de plantas infetadas, com produção de até 310 mg de vírus por kg de folhas de mamoeiro infetado. Antissoros policlonais obtidos de coelhos imunizados com preparações purificadas do vírus reagiram a uma diluição de 1:512.000 em ELISA indireto. Por conta da alta concentração do vírus nos tecidos infetados e sua elevada imunogenicidade, antissoro policlonal específico para PLYV foi também obtido através da imunização oral de coelhos com extratos de folhas infetadas ou com preparações purificadas do vírus. O PLYV é sorologicamente distinto do PRSV e outros vírus dos gêneros Potyvirus, Comovirus e Bromovirus.
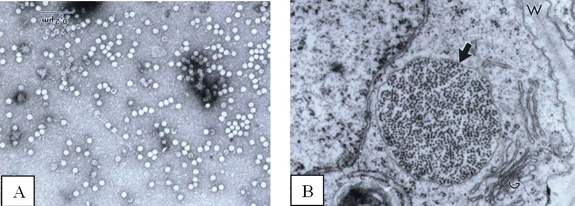
Figuras 3
O vírus possui elevada estabilidade e pode ser detectado em tecidos secos de folhas e de raízes de plantas infetadas mantidas em condições de aproximadamente 26°C até 120 dias. O vírus possui as seguintes propriedades físicas: ponto de inativação térmica (PIT) de 80ºC, longevidade in vitro (LIV) de 60 dias e ponto máximo de diluição (PMD) de 10-6. No entanto, o vírus pode ser inativado em folhas e raízes removidas de plantas infetadas e submetidas à solarização por 12 dias, mas manteve sua infecciosidade quando as folhas e as raízes foram mantidas sobre o solo em condições naturais por 32 dias. O álcool e o detergente neutro (uso comercial) não foram eficientes na inativação do PLYV em ferramentas agrícolas contaminadas. Contudo, o vírus foi inativado com hipoclorito de sódio comercial a 10% durante cinco minutos.
Ciclo da Doença e Epidemiologia
Embora um vetor biológico natural para o PLYV não tenha sido identificado ainda, o vírus é facilmente transmitido por ações do homem, incluindo mãos contaminadas, ferramentas agrícolas, solo e água de irrigação. Estudos indicaram que o vírus não é transmitido por Aphis gossypii, Mizus persicae, Diabrotica bivitulla ou D. speciosa. De outra parte, PLYV infeccioso foi biológica e sorologicamente detectado em solos contaminados, água que havia sido usada na irrigação de plantas infetadas e na superfície de sementes de frutos de mamão infetado. Embora detectado sobre a superfície de sementes de frutos infetados, o vírus não foi detectado no embrião das sementes nem foi transmitido por sementes colhidas de frutos infetados. O vírus continua sendo disseminado a cada ano. A ocorrência do vírus em pequenos grupos de plantas infetadas dentro ou nas bordas dos pomares sugere que o vírus é, provavelmente, introduzido por mudas infetadas ou ferramentas contaminadas e disseminado pelas atividades dos produtores a partir dessas fontes iniciais de inóculo para plantas vizinhas.
Manejo da Doença (Meios de luta, pt)
Diversas estratégias são recomendadas para controlar o PLYV, incluindo as seguintes medidas: uso de mudas livres de vírus; erradicação de plantas infetadas; uso de desinfetantes para o tratamento de ferramentas agrícolas para prevenir a transmissão e adoção de outras práticas culturais para reduzir a transmissão do vírus pelas mãos do homem (exemplo: uso e mudança frequente de luvas de borracha). No entanto, as medidas preventivas são as mais indicadas para o controle do PLYV.
Produção de Mudas Livres de Vírus
Os viveiros para formação de mudas (Figura 4) devem ser isolados, em áreas livres da incidência do vírus e distantes de antigos pomares de mamoeiro que possam estar infetados com o vírus. No passado, o uso de mudas infetadas contribuiu para a dispersão do vírus dentro de regiões ou estados produtores. Este procedimento, possivelmente introduziu o vírus no estabelecimento de pomares. Mudas infetadas são provavelmente as fontes primárias do vírus dentro dos pomares em formação e a disseminação do vírus dentro dos pomares é o resultado das práticas agrícolas correntes. Por esta razão, a produção de mudas em telados afastados dos pomares de produção comercial representa uma importante estratégia de controle para o PLYV, especialmente quando os pomares são localizados em áreas livres de vírus. As mudas produzidas em telados devem ser sorologicamente indexadas e certificadas como livres de PRSV e PLYV. Companhias agrícolas para produção de mudas de fruteiras tropicais e olerícolas no Nordeste Brasileiro estão produzindo mudas de mamoeiro através do uso de sementes de variedades de mamoeiro de boa qualidade agronômica e livres de vírus (Figura 4).

Figuras 4
Erradicação de Fontes de Vírus
Plantas infetadas por vírus exibindo sintomas devem ser eliminadas. Pomares de mamoeiro velhos e improdutivos, mesmo que não estejam apresentando sintomas devem ser também eliminados. Um programa eficiente de erradicação deve compreender a eliminação de todas as fontes de vírus dentro e nas proximidades dos locais onde os pomares serão implantados. A eliminação das fontes de PLYV no campo deve ser orientada e acompanhada por técnicos devidamente treinados para reconhecer as plantas infetadas. Nos casos de suspeitas de infecção do vírus, amostras das plantas devem ser encaminhadas para indexação sorológica com relação à presença do vírus. Os programas de erradicação devem incluir a participação das associações de produtores e órgãos governamentais. Nos pomares já instalados, dependendo do grau de incidência, a prática de rouging (erradicação de fontes iniciais de vírus dentro do pomar) deve ser praticada como medida complementar de controle. Plantas erradicadas devem ser submetidas a solarização por um período de 15 dias o qual foi demonstrado ser eficiente para inativação do vírus. A prática de rouging tem-se mostrado eficiente em várias áreas de produção de mamão para o controle do PRSV que é eficientemente transmitido por afídeos. Considerando as dificuldades da conscientização dos produtores sobre a importância do programa de erradicação para o controle de viroses do mamoeiro, a Secretaria de Defesa Agropecuária do Ministério da Agricultura do Brasil aprovou lei estabelecendo que todos os produtores fossem obrigados a seguir as normas do programa de erradicação para o controle da mancha anelar do mamoeiro. De acordo com o que estabelecia a lei, os produtores que não seguissem as normas do programa de erradicação teriam seus pomares inspecionados e aqueles com plantas infetadas seriam condenados. O sucesso do programa de erradicação para controle do PRSV em longo prazo é questionável, especialmente em razão de programas anteriores terem perdido sua eficiência ao longo do tempo em outras regiões, inclusive no Havaí. A erradicação de plantas infetadas para o controle do PLYV pode ter seu sucesso assegurado ao longo dos anos, em razão do PLYV aparentemente não possuir vetor biológico para sua disseminação no campo.
Desinfestação de Ferramentas Agrícolas
Em razão da elevada estabilidade do PLYV, sua inativação nas superfícies de ferramentas agrícolas contaminadas constitui uma importante medida para evitar a disseminação dentro de um determinado pomar. As ferramentas agrícolas usadas no procedimento de podas e colheita de frutos num pomar de mamoeiro deveriam ser imersas durante cinco minutos em solução a 10% de água sanitária comercial (lixívia, pt) (que contem hipoclorito de sódio), após serem utilizados com cada planta.
Evitar a Transmissão do Vírus
Em razão da elevada estabilidade do PLYV, cuidados devem ser tomados no sentido de evitar a transmissão do vírus dentro dos pomares, através do movimento de solos contaminados, água de irrigação, superfície de sementes de frutos infetados e ferramentas agrícolas contaminadas.
Significância
Entre as doenças que afetam o mamoeiro, aquelas ocasionadas por vírus causam as maiores perdas em todo o mundo. Os principais vírus que infetam o mamoeiro no Nordeste do Brasil são Papaya Ringspot Virus (PRSV), família Potyviridae, gênero Potyvirus; Papaya Lethal Yellowing Virus (PLYV), gênero Sobemovirus e Papaya Meleira Virus(PMeV). Como ainda se encontra em fase de caracterização, o PMeV ainda não foi classificado pelo Comitê Internacional de Taxonomia de Vírus (International Committee on Taxonomy of Viruses, ICTV).
O amarelo letal do mamoeiro é uma doença ocasionada pelo PLYV e tem sido detectada somente no Nordeste do Brasil. O vírus foi inicialmente detectado no estado de Pernambuco, seguido do Rio Grande do Norte, Paraíba e Ceará. No estado do Ceará, o vírus foi inicialmente detectado nos municípios próximos do Rio Grande do Norte e ainda não foi constatado no estado do Piauí (oeste do Ceará) nem nos municípios do Ceará próximos ao estado do Piauí. A doença tem-se constituído num sério problema para os produtores de mamão da região em razão dos danos causados à produção e sua crescente dispersão através dos pomares de mamoeiro. A origem do PLYV é desconhecida, mas o vírus pode ter vindo de plantas nativas hospedeiras em condições naturais ou ser resultante de uma possível mutação de outro vírus existente na região. A dispersão do vírus na região Nordeste vem ocorrendo no sentido leste-oeste.
Extensivos e detalhados levantamentos da doença em áreas produtoras de municípios do Ceará e do Rio Grande do Norte revelaram baixa incidência do PLYV em pomares de mamoeiro visitados. O vírus estava distribuído em pequenas reboleiras de plantas dentro ou nas bordas dos pomares. Esse tipo de distribuição da doença indica que o vírus é provavelmente introduzido através de mudas infetadas ou por ferramentas contaminadas, sendo subsequentemente disseminado para plantas vizinhas através das atividades dos produtores.
Referências Selecionadas
Camarço, R.F.E.A., Lima, J.A.A., and Pio-Ribeiro, G. 1998. Transmissão e presença em solo do "Papaya lethal yellowing virus". Fitopatologia Brasileira 23:453-458.
Daltro, C.B., Pereira, A.J., Cascardo, R.S., Alfenas-Zerbini, P., Beserra Jr, J.E.A., Lima, J.A.A., Zerbini, F.M., Zerbini, F.M., and Andrade, E.C. 2012. Genetic variability of papaya lethal yellowing virus isolates from Ceará and Rio Grande do Norte states, Brazil. Tropical Plant Pathology 37:37-43.
Gonsalves, D. 1998. Control of papaya ringspot virus in papaya: A case study. Annual Review Phytopathology 36:415-437.
Kitajima, E.W., Oliveira, F.C., Pinheiro, C.R.S, Soares, L.M., Pinheiro, K., Madeira, M.C., and Chagas, M. 1992. Amarelo letal do mamoeiro solo no estado do Rio Grande do Norte. Fitopatologia Brasileira 17:282-285.
Lima, J.A.A., Lima, A.R.T., and Marques, M.A.L. 1994. Purificação e caracterização sorológica de um isolado do vírus do amarelo letal do mamoeiro 'solo' obtido no Ceará. Fitopatologia Brasileira 19:437-441.
Loreto, T.J.G., Vital, A.F., and Rezende, J.A.M. 1983. Ocorrência de um amarelo letal do mamoeiro solo no estado de Pernambuco. O Biológico 49:275-279.
Nascimento, A.K.Q., Lima, J.A.A., Nascimento, A.L.L., Beserra, E.A.Jr., and Purcifull, D. 2010. Biological, physical, and molecular properties of a Papaya lethal yellowing virus isolate. Plant Disease 94:1206-1212.
Ramos, N.F., Nascimento, A.K.Q., Goncalves, M.F.B., and Lima, J. A. A. 2008. Presença dos vírus da mancha anelar e do amarelo letal em frutos de mamoeiro comercializados. Tropical Plant Pathology 33: 449-452.
Saraiva, A.C.M., Paiva, W.O., Rabelo Filho, F.A.C., and Lima, J.A.A. 2006. Transmissão por mãos contaminada e ausência de transmissão embrionária do vírus do amarelo letal do mamoeiro. Fitopatologia Brasileira 31: 79-83.
Silva, A.M.R., Kitajima, E.W., Souza, M.V., and Resende, R. 1997. Papaya lethal yellowing virus: a possible member of the Tombusvirus genus. Fitopatologia Brasileira 22:529-534
Teixeira, M.G.C.; Lima, J.A.A., Sousa, A.E.B.A., and Fernandes, E.R. 1999. Baixos graus de incidência do vírus do amarelo letal do mamoeiro em municípios do Rio Grande do Norte. Caatinga 12:29-33.