Sigatoka negra
Mycosphaerella fijiensis - se encuentra en casi todas las regiones del mundo donde se cultivan plátanos.
Musa spp. (bananeros y plátaneros)
Figura 1. Presione sobre la imagen para ampliarla.
Traductor: Robert J. Knight, Jr. , University of Florida, IFAS, Tropical Research & Education Center, Homestead, FL USA
Redactores: Gloria Abad 1, Jorge Abad 1, Gustavo Astua-Monge 2 and Carlos Balerdi 3.
1 North Carolina State University, Raleigh, NC, USA,
2 Laboratorio de Biotecnologia, Centro APTA Citros Sylvio Moreira, Rod. Anhanguera Km 158 - CP 04 - Cordeiropolis, Sao Paulo, Brasil CEP,
3 University of Florida/Miami-Dade County Cooperative Extension, Homestead, FL, USA

Figure 2. Presione sobre la imagen para ampliarla.
Síntomas y signos
Los primeros síntomas de la enfermedad de Sigatoka negra son manchas cloróticas muy pequeñas que aparecen en la superficie inferior (abaxial) de la tercera o cuarta hoja abierta. Las manchas crecen convirtiéndose en rayas de color marrón delimitadas por las nervaduras. (Figura 3). El color de las rayas va haciéndose más oscuro, algunas veces con un matiz púrpura, y visible en la superficie superior (adaxial). Luego las lesiones se amplían, tornándose fusiformes o elípticas, y se oscurecen aún mas formando las rayas negras de las hojas características de la enfermedad (Figura 4). El tejido adyacente frecuentemente tiene una apariencia como empapado o mojado, especialmente cuando está bajo condiciones de alta humedad.
 |
 |
| Figura 3 |
Figura 4 |
Cuando el grado de severidad de la enfermedad es alto, grandes áreas de la hoja pueden ennegrecer y lucir empapadas. En el tejido necrótico numerosos cuerpos de fructificación (pseudotecios), diminutos, negros y globosos que contienen estructuras como sacos o bolsas (ascas) llenos de ascosporas van a emerger de la base de la hoja (Figura 5).
 |
| Figura 5 |
La Sigatoka negra, que fue reportada por primera vez en Fiji en 1964, recibe su nombre al aparecer como una forma distinta de la Sigatoka amarilla. Las rayas y manchas jóvenes tienen el color negro y carecen del halo amarillo característico que está presente en las rayas jóvenes de la Sigatoka amarilla. Aunque las lesiones en la Sigatoka amarilla (Mycosphaerella musicola) pueden ser semejantes a las de la negra, uno puede distinguirlas de las de la Sigatoka negra examinando la forma de los conidióforos (ver el cuadro a continuación). Mycosphaerella fijiensis produce conidióforos en grupos pequeños y no en grupos grandes (esporodóquios) como M. musicola. También M. fijiensis tiene cicatrices en la base de las conidias y en los puntos de unión de los conidióforos. Mycosphaerella fijiensis produce la mayoría de sus conidias (esporas asexuales) y las estructuras que producen las esporas masculinas (espermogonios) en el lado basal de la hoja, mientras que M. musicola produce sus conidias predominantemente en la superficie superior de la hoja. Los síntomas de la Sigatoka amarilla (Figuras 6 y 7) típicamente se desarrollan más lentamente que los síntomas de la Sigatoka negra (Figura 8) (Ver abajo: Comparación de la Sigatoka Amarilla y Negra). También el diagnóstico puede ser realizado con el uso de la reacción en cadena de la polímerasa (PCR).
 |
 |
| Figura 6 |
Figura 7 |
 |
| Figura 8 |
Si no se controla, la Sigatoka negra avanzará rápidamente por la superficie de la hoja, reduciendo la capacidad de fotosíntesis y así el rendimiento (Figura 9).
 |
| Figura 9 |
Comparación de la Sigatoka Negra y Amarilla
| Patógeno |
| SIGATOKA AMARILLA |
SIGATOKA NEGRA |
Mycosphaerella musicola
(Pseudocercospora musae) |
Mycosphaerella fijiensis
(Pseudocercospora fijiensis) |
- los conidióforos son formados en grupos densos (esporodóquios) sobre estromas oscuros en ambas superficies de la hoja
- los conidióforos son rectos, usualmente sin septas y sin ramificados, sin cicatrices de esporas.
- conidias de grosor uniforme por toda su longitud, con 1-5 septas, sin una clara cicatriz basal
|
- se forma solo un conidióforo o pequeños grupos (2-5) en la superficie inferior de la hoja.
- los conidióforos son rectos o torcidos, con 0-3 septas y ocasionalmente ramificados, con cicatrices de esporas un poco gruesas.
- conidias se estrechan de la base al ápice, con 1-6 septas, y tienen una clara cicatriz basal
|
| Hospederos |
| SIGATOKA AMARILLA |
SIGATOKA NEGRA |
Los bananeros (AAA) generalmente son susceptibles; los bananos y plátanos para cocinar (AAB y ABB) en su mayor parte son de mediana a altamente resistentes
|
Los bananeros de postre, los bananos y plátanos para cocinar en su por mayor parte son susceptibles
|
| Síntomas |
| SIGATOKA AMARILLA |
SIGATOKA NEGRA |
- la raya inicial es de color amarillo pálido
- las rayas se manifiestan en las hojas 4-5 (Cavendish sin fumigación)
|
- la raya inicial es de color marrón oscuro
- las rayas se manifiestan en las hojas 2-4 (Cavendish sin fumigación)
|
| Epidemiología |
| SIGATOKA AMARILLA |
SIGATOKA NEGRA |
- más común en los ambientes más frescos
- el inóculo consiste en ambas conidias (dispersadas por agua) y ascosporas (dispersadas por el viento)
- las conidias se manifiestan inicialmente en la etapa de mancha adulta
- produce más de 30,000 conidias por mancha
- conidias no son desplazadas por el viento
- las ascosporas maduras son producidas 4 semanas después que aparecen las rayas
|
- más común en los ambientes más cálidos
- las ascosporas dispersadas por el viento constituyen el mayor inóculo
- las conidias se manifiestan inicialmente en la etapa de raya temprana
- produce cerca de 1,200 conidias por mancha
- conidias son dispersadas por el agua y por el viento
- las ascosporas maduras son producidas 2 semanas después que aparecen las rayas
|
Biología del Patógeno
Reproducción sexual
Mycosphaerella fijiensis es el nombre que fue dado a la forma sexual (teleomorfa) del patógeno. El hongo fue inicialmente descrito en 1969 por Morelet en muestras de Fiji.
Para producir la forma sexual el hongo inicialmente desarrolla muchos espermogonios en la superficie inferior de la hoja al colapsar las lesiones. El espermogonio (Figura 10) es oscuro, un poco errumpente, y de forma piriforme. En condiciones húmedas estas estructuras pueden producir grandes cantidades de células de reproducción masculina (espermatias). Las espermatias son diminutas y cilíndricas y van a fertilizar las hifas hembras vecinas llamadas tricóginas.
 |
| Figura 10 |
Al efectuarse la fertilización, los pseudotecios se forman dentro de las lesiones maduras con los ostiolos emergiendo de los tejidos (Figura 11). Las ascas, estructuras oblongas o en forma de mazo tienen dos paredes (son bitunicadas) y contienen ocho esporas sexuales (ascosporas) que están alineadas de dos en dos. Las pseudoparafisas o elementos estériles están ausentes del pseudotecio. Las ascosporas son hialinas y poseen una septa. Una célula de la espora puede ser un poco más ancha que la otra célula, y la espora puede ser un poco estrecha en la septa. Una preparación microscópica del pseudotecio se muestra en la Figura 12.
 |
 |
| Figura 11 |
Figura 12 |
Reproducción asexual
La forma asexual (anamorfa) se llama Pseudocercospora fijiensis. Las conidias se originan individualmente y apicalmente en el conidióforo. Las esporas son de color pálido a un ligero olivo-carmelitoso, estas son lisas, largas y tienen tres o más septas (Figura 13).
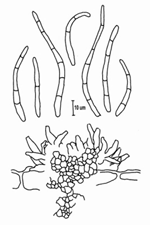 |
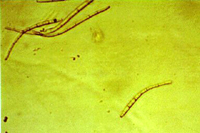 |
| Figura 13 |
Figura 14 |
Las conidias germinan durante períodos de alta humedad relativa (92 – 100% humedad relativa) e infectan a la hoja a través de los estomas, usualmente en la superficie inferior. Bajo condiciones de alta humedad, las hifas pueden emerger por los estomas y crecer a lo largo de la superficie de la hoja y penetrar por otros estomas, así agrandando las lesiones. Los conidióforos emergen por los estomas, y algunas veces sobre errumpentes masas compactas de micelio (estromas). Los estromas también pueden desarrollarse sobre espermogonios jóvenes.
Ciclo de la Enfermedad y Epidemiología
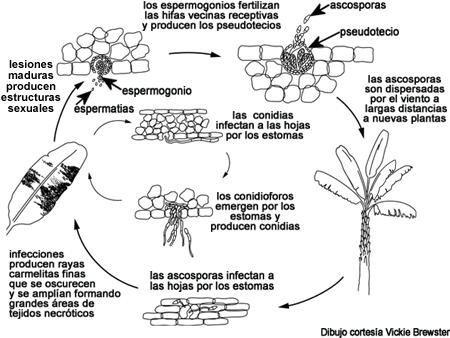
ciclo de la enfermedad
Epidemiología
En la Sigatoka negra las ascosporas y en cierta medida las conidias, constituyen los propágulos por los cuales el hongo se disemina.
Las conidias se forman fácilmente bajo humedad alta, especialmente si una película de agua está presente en las hojas. Estas esporas asexuales se diseminan durante acarreos de lluvia y al salpicar causando la propagación local de la enfermedad.
Los pseudotecios maduran cuando los tejidos muertos de la hoja están saturados con agua por aproximadamente 48 horas. Las ascosporas constituyen el primer medio de dispersión a largas distancias y proveen el mayor medio de propagación durante épocas extendidas de tiempo lluvioso. Mycosphaerella fijiensis forma relativamente pocas conidias y por eso se cree que las ascosporas son de más importancia en el ciclo de la enfermedad.
La mancha de hoja Sigatoka en bananeros desminuye un poco durante la época seca pero los ciclos de infección se repiten continuamente (Figura 15).
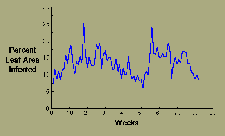 |
| Figura 15 |
Manejo de la Enfermedad
Fungicidas
Las plantaciones grandes ponen mucha confianza en los controles químicos. Los programas de control están en su mayor parte basados en los fungicidas protectores como mancozeb (usualmente aplicado en agua o en combinación con aceite) y clorotalonil. El mancozeb frecuentemente se aplica en combinación o en rotación con morfolina, con inhibidores de demetilación (IDMs), o con fungicidas estrobilurinas (Qols). El clorotalonil se rota pero no se combina con otros fungicidas. La resistencia a los fungicidas benzimidazol, IDM y estrobilurin es muy común en muchas áreas de producción. Los fungicidas frecuentemente son aplicados por avión (Figura 16).
 |
| Figura 16 |
Control Biológico
Investigaciones dirigidas al desarrollo de métodos de control biológico para la Sigatoka negra han sido limitadas porque los controles químicos, que son altamente efectivos y económicos, están ampliamente disponibles a los productores comerciales. Aunque los métodos de control biológico son deseables principalmente para la protección del ambiente, su aplicación con éxito probablemente será difícil porque la Sigatoka negra es una enfermedad policíclica y el tejido susceptible del bananero está presente todo el año. Se han probado varias bacterias epifíticas (incluyendo Pseudomonas, Bacillus y Serratia spp.) para el control de M. fijiensis, pero aún la investigación del control biológico está en sus etapas preliminares.
Cultivares resistentes
El uso de cultivares resistentes constituye en efecto el único medio práctico de controlar la Sigatoka negra para el agricultor pequeño o de subsistencia porque los fungicidas en general son muy caros para ellos. Desgraciadamente aunque existen cultivares resistentes de plátanos y bananeros disponibles, muchas veces son inaceptables a las preferencias locales. Una prioridad importante de los centros internacionales de investigación es el desarrollo de cultivares resistentes aceptables (Figura 17).
 |
| Figura 17 |
Sin embargo, obtener resistencia a enfermedades es especialmente difícil con los bananeros. Los cultivares comerciales son autotriploides (AAA), es decir que tienen tres ejemplares del complemento de cromosomas en vez de dos que tienen las especies diploides silvestres. Aunque este complemento adicional de cromosomas transmite características comerciales favorables como p.ej. la falta de semillas (diferente al de las especies diploides silvestres, figura 18), y también un mayor tamaño de la planta y la fruta, el nivel alto de esterilidad constituye un obstáculo grande para los fitogeneticistas de plátanos. Es más, el tiempo de una generación de banano (de semilla a semilla) es de tres largos años.
 |
| Figura 18 |
Manejo del cultivo
Las técnicas de manejo como el espaciamento mas amplio de las plantas, mejor drenaje de ambos agua y aire, mejor manejo de malezas y quitar las hojas que están severamente enfermas, o partes de ellas, también pueden ser usadas para mejorar el control. Simplemente quitar las hojas infectadas (deshojar) y ponerlas en el suelo puede reducir la eficacia de emisión de las ascosporas significativamente (Figura 19). La aplicación de urea y otros productos a los residuos infestados en el suelo puede acelerar la descomposición de éstas y así reducir más la fuente de inóculo.
 |
| Figura 19 |
Cuarentena y Sanidad
Las medidas adecuadas de cuarentena y sanidad pueden proveer alguna protección contra los dos comunes medios de dispersión a larga distancia del inóculo (las hojas y los rizomas). Hojas contaminadas de plátano frecuentemente son usadas para proteger las frutas de plátano cuando son transportadas por camión.
Existen medidas de cuarentena en algunos lugares y países donde la M. fijiensis no está establecida o está limitada a ciertas áreas (Figuras 20 y 21).
 |
 |
| Figura 20 |
Figura 21 |
Importancia
Pérdidas e Impacto Económico
La enfermedad de la Sigatoka negra es particularmente devastadora. Bajo condiciones favorables, la necrosis de las hojas puede reducir los rendimientos de 35-50%, y muchos cultivares que son importantes y comúnmente sembrados son susceptibles. En 1995 el costo medio para controlar esta enfermedad fue de EEUU$1500/ha/año. Anualmente, una plantación típica necesita de 38-50 fumigaciones, y estas aplicaciones de fungicidas pueden subir aproximadamente en un 30% los costos de producción. En Centroamérica, la Sigatoka negra puede añadir un 27% del costo total de producción, mientras que las otras enfermedades y plagas suben solamente del 3-5% de la totalidad del costo de producción.
Generalmente es necesario mantener una cantidad mínima de cinco hojas en la planta hasta el tiempo de cosecha para que la calidad de las frutas sea estable durante el transporte. Las frutas de plantas gravemente enfermas son propensas a ablandarse prematura e irregularmente. Esto constituye una preocupación grave para los que producen fruto para exportación debido a las exigencias rígidas de los consumidores en los países desarrollados.
Aunque operaciones a gran escala pueden asimilar el costo de la fumigación, la mayoría de los productores pequeños no pueden permitirse el lujo de controles químicos y por eso son más propensos a sufrir pérdidas. Esto pone una preocupación seria en los programas destinados a garantizar la comida a los agricultores de subsistencia, particularmente para los que dependen de plátanos para cocinar en sus dietas. En muchos lugares del mundo, principalmente en ciertas partes de África, los plátanos constituyen un alimento básico primario (Figura 22).
 |
| Figura 22 |
Referencias Seleccionadas
International Mycosphaerella Genomics Consortium (IMGC)
Marín, D.H., R.A. Romero, M. Guzman, and T.B. Sutton. 2003. Black Sigatoka: an increasing threat to banana cultivation. Plant Dis. 87:208-222.
Ploetz, R.C., G.Z. Zentmyer, W.T. Nishijima, K.G. Rohrbach, and H.D. Ohr. 1994. Compendium of Tropical Fruit Diseases. American Phytopathological Society Press. St. Paul, MN.
Ploetz, R.C. 1999. Black Sigatoka of Banana: The most important disease of a most important fruit. APSnet feature article: http://publish.apsnet.org/publications/apsnetfeatures/Pages/BlackSigatoka.aspx
Promusa Sitio de Web: http://www.promusa.org/
Stover, R.H. 1980. Sigatoka leaf spot diseases of bananas and plantains. Plant Dis. 64:750-756.
Stover, R.H. 1986. Disease management strategies and the survival of the banana industry. Ann. Rev. Phytopathol. 24:83-91.
Thurston, H.D. 1998. Tropical Plant Diseases. American Phytopathological Society Press. St. Paul, MN.